我是廣告 請繼續往下閱讀
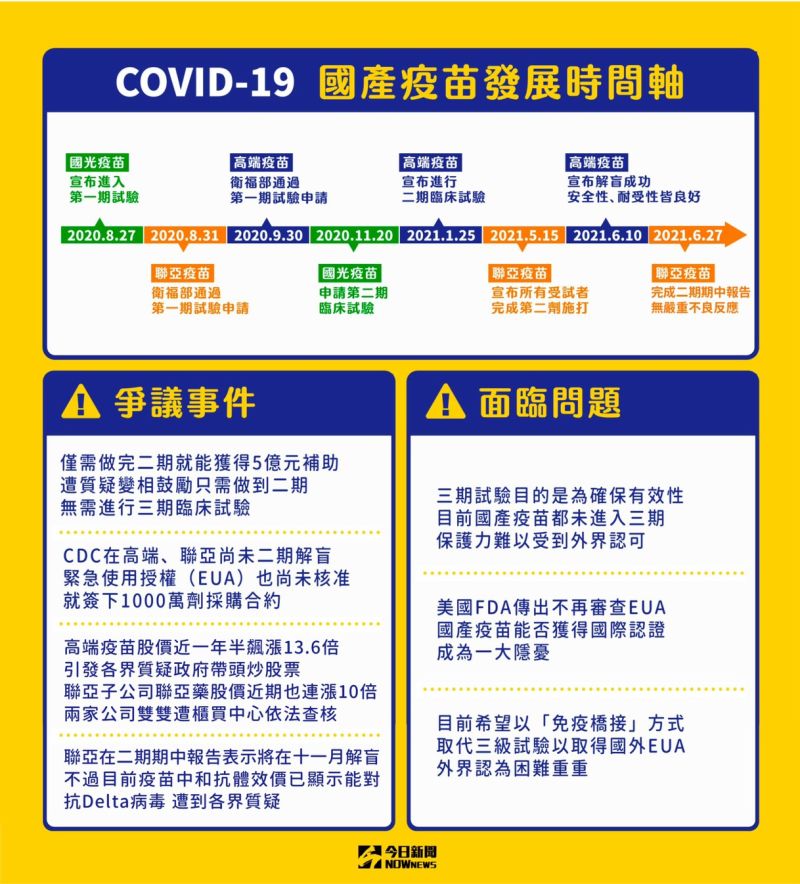
高端疫苗在2020年2月17日宣布與美國國家衛生研究院(National Institutes of Health, NIH)簽訂合約,在5月5日,高端正式與NIH簽署商業授權合約,取得美國NIH新冠肺炎重組棘蛋白之原始生物材料、驗證用抗體、技術平台、及此平台和候選疫苗之相關專利等權利,以便進行疫苗開發、製造、銷售。
2020年9月30日衛福部許可高端公司進行第一期臨床試驗,並在10月初第一批臨床試驗受試者已在台大醫院展開COVID-19疫苗接種,12月29日衛福部審查通過高端疫苗第二期臨床試驗申請,隨後在2021年1月25日高端宣布進行二期臨床試驗﹔4月28日高端表示,3700名受試者皆已完成第二劑施打﹔最後在6月10日高端宣布疫苗解盲,安全性、耐受性皆良好,所有受試者未出現疫苗相關嚴重不良反應。
高端疫苗在7月6日公告,將於巴拉圭亞松森大學附設醫院執行疫苗第三期人體臨床試驗,採免疫橋接設計與AstraZeneca (AZ)疫苗進行比對性試驗,已向DINAVISA提出第三期臨床試驗申請。

聯亞生技宣布投入疫苗研發後,在2020年8月30日通過衛福部審查通過聯亞疫苗第一期臨床試驗申請,不過,直到今年1月29日衛福部才審查通過聯亞疫苗第二期臨床試驗申請。
聯亞疫苗在4月15日以前所有受試者完成第一劑施打,到了5月15日所有受試者完成第二劑施打,6月27日進行二期臨床試驗期中分析報告。聯亞表示,UB-612疫苗安全性與耐受性良好,所有受試者未出現與疫苗相關的嚴重不良反應,沒有外界最關心的保護力多寡,不過,聯亞也表示,UB-612的中和抗體效架,顯示對變種病毒具保護力,能對抗Delta變種病毒。
聯亞目前規劃在今年11月中下旬進行試驗解盲,屆時保護力多寡的答案才會揭曉,並且已經將首批要交付給政府的28萬劑疫苗提前生產完成,日前已經移至桃園龜山物流中心進行外倉保存,採解盲、量產同步進。
國光疫苗:
國光生技原本是台灣最先投入疫苗研發的公司,在2020年3月份國光生技率先與國衛院簽訂合作意向書,共同研發新冠病毒疫苗,也搶先各家在6月22日向衛福部食藥署提出提出人體試驗申請,食藥署也在8月17日同意後,在20日發布首張核准函。
國光生技8月27日國光生技宣布進入第一期臨床試驗,到了11月20日國光生技申請第二期臨床試驗,不過12月底卻傳出傳一期臨床試驗抗體力價表現不如預期,二期進度卡關。
不過,國光並未放棄,並表示,已向國外藥證單位申請審查,只要審查順利通過,將在疫情好發區完成三期臨床試驗,強調依國際規範完成臨床三期流程。
尚未解盲中央就宣布購買 圖利傳言甚囂塵上
衛生福利部於2020年7月製定了「補捐助民間團體研發COVID-19疫苗計畫」,訂出最高獲得新台幣5億元的誘因,要求國產疫苗第二期受試人數至少要做到3000人以上的規模,不過該計畫中僅提及第一期及第二期臨床試驗,完全沒有第三期臨床試驗等相關字樣。
讓各界質疑,衛福部從一開始就打算在國產疫苗做完二期臨床後,直接發EUA(Emergency Use Authorization;緊急使用授權)給國產疫苗,好讓國人施打,造成民眾不滿。
指揮中心更在5月30日宣布購買高端、聯亞疫苗各500萬劑,但是當時兩家疫苗公司的疫苗尚未解盲成功,此舉更為中央蓋上一層圖利的嫌疑。
高端疫苗宣布投入新冠疫苗開發後,原本股價在2019年12月31日是28.5元/股,到了2021年1月29日高端股價漲為103元/股,且2月17日到22日更連拉4天漲停板,到了5月17日,高端疫苗的股價已經漲至417元/股,衝上史上新高,股價翻了13.6倍,不免容易讓人懷疑有炒股的嫌疑。
總統蔡英文也因此慘遭台北市長柯文哲狠酸,新冠肺炎死超過百人,蔡不關心,當遇到高端跌停板才出現向民眾發表談話。蔡英文以及總統府都強烈反擊,強調沒有持股,也絕無炒股,政治口水無助防疫。
另外,聯亞生技集團旗下子公司聯亞藥在6月23日以參考價每股30元登錄興櫃,近期更暴漲10倍。聯亞藥與高端兩家公司也雙雙遭櫃買中心依法查核。
國產疫苗三期未進行 能否取得外國EUA成中央最大考驗
由於台灣的高端疫苗都尚未進入三期臨床,在傳統定義中,疫苗第三期臨床試驗的目的,就是要確保疫苗的安全性與有效性,目前國產疫苗都沒有進入第三期,疫苗的保護力難以受外界認可。
國產疫苗的三期臨床試驗會繼續進行,但中央目前急欲走向國際,爭取歐盟及英國的EUA,雖然全球主要疫苗品牌在疫情嚴峻之下,也都還來不及完成三期試驗,但大多數品牌都經過三期臨床試驗的期中報告,才能夠取得緊急使用授權(EUA)。
不過,日前美國食品藥物管理局(FDA)宣布,未來將不再開放新冠肺炎疫苗EUA緊急使用授權,讓國產疫苗能否得到國際認證,成一大問題,也讓國人倍感擔憂。指揮中心期待以「免疫橋接方法」取代三級臨床,來取得國外EUA,目前正發函詢問美國、歐盟和日本意見,不過美方17日回函「目前無法有定論」,仍在討論,被外界解讀該方式希望渺茫。