我是廣告 請繼續往下閱讀
為何生產管理如此混亂,為何能得到審批?舉報信中也指出,這是公司高層給重慶市藥監局又請吃飯、又送紅包,才有辦法辦法通過批准。
舉報信更指出,前 (2016) 年 5 月美國 FDA 赴現場檢查後,就得到警告信,到了去 (2017) 年 11 月美國 FDA 再次現場檢查,又出現嚴重違反藥品管理法規的情況,之後獲美國 FDA 的最差評價結果(OVI)。
《每日經濟新聞》報導,美國 FDA 在 2017 年初發出的警示信中提到,前年 5 月 16 日至 19 日在重慶市南岸區塗山路 565 號檢查重慶醫藥研究院的藥品生產設施,發現其現行有效的藥物活性成分(API)與「良好生產規範」(CGMP)的重大偏差。
信件更直指:「製造、加工、包裝或保存方式、設施或製作都不符合生產規範,因此在聯邦食品、藥品和化妝品法第 501(a)(2) (B)條,以及美國聯邦法典第 351(a)(2)(B)條的定義範圍內,您的藥物活性成分是摻假的」。
FDA 在警示信中指出,審查過程中發現重慶醫工院以人為刪除原始的不符合規範的資料或不希望看到的試驗結果,以修改後的試驗結果和不完整記錄來支撐藥品發佈。
對此復星醫藥今日發布聲明表示,前年 5 月 FDA 對重慶醫工院提出警告信號,已經處理當時相關負責人,之後並進行相關整改,希望日後能盡快通過 FDA 現場檢查。
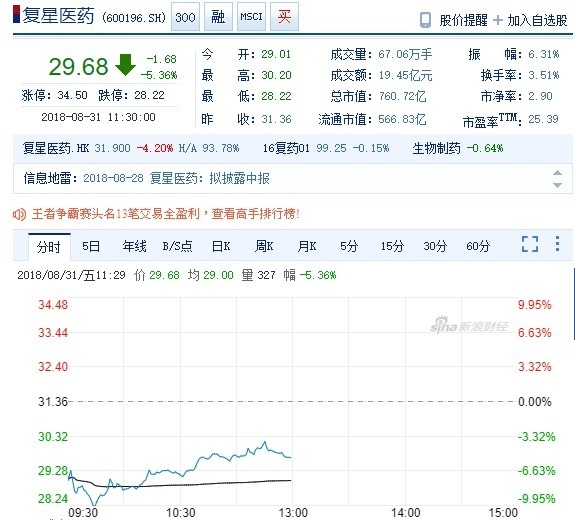
這是繼先前長生生物疫苗造假後,另一起中國藥廠的造假事件。復星醫藥今日開盤股價曾一度重挫跌停,之後跌幅雖然縮小,至午盤為止,收跌 5.36%。
更多精彩內容請至 《鉅亨網》 連結>>


