(中央社台北16日電)中國官方今天公布,新增450例COVID-19本土病例,包括75例確診及375例無症狀感染者。在疫情反覆之際,首款國產口服藥物「阿茲夫定」日前申請上市並獲受理。
中國國家衛生健康委員會官網上午公布,15日零至24時,中國大陸各地新增75本土確診,包括甘肅31例、安徽16例、廣東15例、上海5例、海南5例、江蘇1例、河南1例、四川1例;另有54例境外移入確診。
新增的375本土無症狀感染者則以安徽最多,占了139例;另有43例境外移入無症狀感染。
截至15日24時,中國大陸現有確診1169例(其中重症1例),累計報告確診病例22萬7272例,5226人病亡。
中國各地疫情近日反彈讓官方充滿爭議的清零政策更受質疑和考驗。海南海口官方昨天舉行記者會表示,為鞏固當前疫情防控成果,全力衝刺「7天社會面清零」目標,海口4個區將於16至18日在重點區域展開3輪區域核酸檢測,力爭最短時間全面排除潛在的社會面傳播隱患。
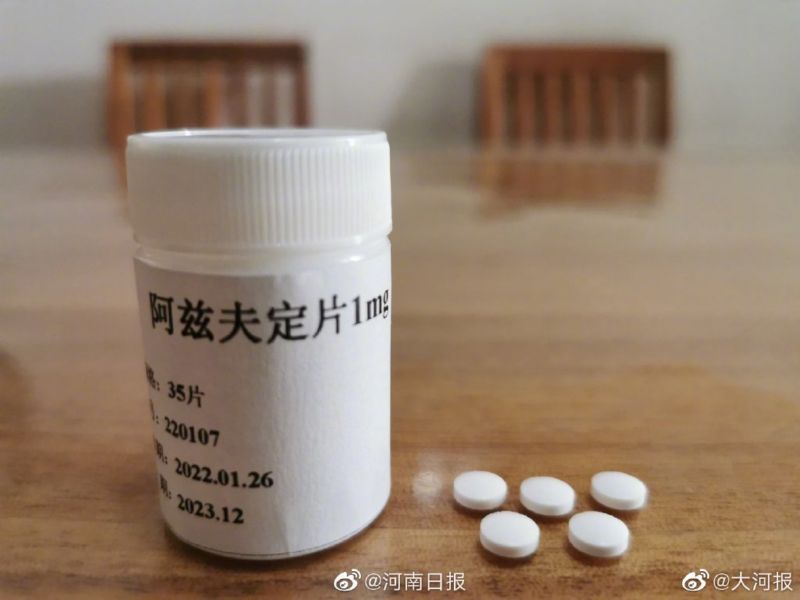
疫情反覆之際,綜合河南日報網等陸媒報導,首款中國國產COVID-19口服藥物「阿茲夫定」(Azvudine)日前正式向國家藥品監督管理局提交治療COVID-19病毒適應症的上市申請,並已獲受理。
阿茲夫定由河南真實生物科技有限公司研發生產,是全球首個雙靶標抗愛滋創新藥,已在中國、美國等多個國家申請專利並獲授權。
據表示,作為抗病毒小分子口服藥,阿茲夫定具有廣譜抑制RNA病毒複製的作用,COVID-19病毒同屬以RNA作為遺傳物質的病毒,臨床試驗證明,該藥對COVID-19病毒有良好抑制作用。
報導說,阿茲夫定早於2020年2月就被發現可抗COVID-19病毒;同年4月經中國國家食品藥品監督管理局批准進行三期臨床試驗。
三期臨床試驗結果顯示,阿茲夫定可顯著改善臨床症狀,顯著縮短中度患者症狀改善時間,並可抑制COVID-19病毒活性,病毒清除時間為5天左右。公司測算,單療程約人民幣240元(約合新台幣1080元)。(編輯:周慧盈/沈朋達)1110716
我是廣告 請繼續往下閱讀
新增的375本土無症狀感染者則以安徽最多,占了139例;另有43例境外移入無症狀感染。
截至15日24時,中國大陸現有確診1169例(其中重症1例),累計報告確診病例22萬7272例,5226人病亡。
中國各地疫情近日反彈讓官方充滿爭議的清零政策更受質疑和考驗。海南海口官方昨天舉行記者會表示,為鞏固當前疫情防控成果,全力衝刺「7天社會面清零」目標,海口4個區將於16至18日在重點區域展開3輪區域核酸檢測,力爭最短時間全面排除潛在的社會面傳播隱患。
疫情反覆之際,綜合河南日報網等陸媒報導,首款中國國產COVID-19口服藥物「阿茲夫定」(Azvudine)日前正式向國家藥品監督管理局提交治療COVID-19病毒適應症的上市申請,並已獲受理。
阿茲夫定由河南真實生物科技有限公司研發生產,是全球首個雙靶標抗愛滋創新藥,已在中國、美國等多個國家申請專利並獲授權。
據表示,作為抗病毒小分子口服藥,阿茲夫定具有廣譜抑制RNA病毒複製的作用,COVID-19病毒同屬以RNA作為遺傳物質的病毒,臨床試驗證明,該藥對COVID-19病毒有良好抑制作用。
報導說,阿茲夫定早於2020年2月就被發現可抗COVID-19病毒;同年4月經中國國家食品藥品監督管理局批准進行三期臨床試驗。
三期臨床試驗結果顯示,阿茲夫定可顯著改善臨床症狀,顯著縮短中度患者症狀改善時間,並可抑制COVID-19病毒活性,病毒清除時間為5天左右。公司測算,單療程約人民幣240元(約合新台幣1080元)。(編輯:周慧盈/沈朋達)1110716