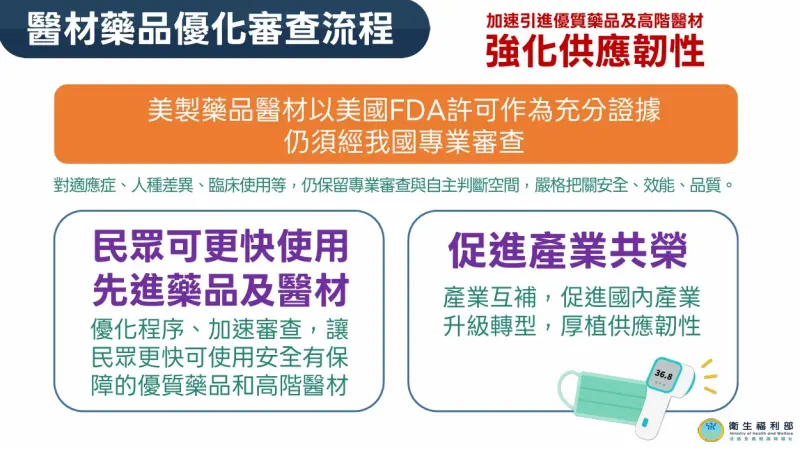
台美完成對等貿易協定簽署,其中3大重點包含「加速先進美製醫藥品審查」、「維持基因改造食品輸入管理未變」且進一步加強邊境混摻通報;以及「美牛、美豬管理接軌國際標準」,衛福部指出,未來通過美國食品藥物管理局審查的美製醫材與藥品,可在美國上市作為申請我國許可證的充分證據;自費醫材核價單一平台,無須22縣市逐一審,簡化程序,加速臨床應用。
衛福部食藥署副署長王德原受訪時指出,美製醫藥品在健保給付、醫療品接軌國際這塊對國人很重要的一部分,而美國作為全球醫療科技強國,在研發、生產、製造藥品及醫療器材上都有其優勢。
王德原指出,此次協議內容主要針對未來有通過美國食品藥物管理局審查的「美國製造醫療器材及藥品」,有美國FDA核發的上市許可,就可作為申請我國藥品藥證或醫材許可證的充分證據。
王德原解釋,目前藥品申請查驗登記要檢附研發、產品規格、製造、管制GMP等資料,還有臨床醫學、藥廠等相關資料並送到我國食藥署審查。而這樣的審查過程可能會超過一年,因此在台美關稅協定簽訂後,未來美國FDA美國核發的美國製造藥品,台灣這端是針對人種差異、適應症、臨床如何使用等,都還是會透過食藥署專業審查。
王德原說,但各自醫療體系、醫師診斷開藥的方式還是有不同。
不過,縮短時間多久,王德原則說,較難說明精準時間,但整個程序都會加快,只是每個產品所提供的資料完整度仍有差異;但整體會加速民眾使用安全有保障的優質藥品與高階醫材。此外,建置自費醫材核價單一平台,無須22縣市逐一審,簡化程序,加速臨床應用。
我是廣告 請繼續往下閱讀
王德原指出,此次協議內容主要針對未來有通過美國食品藥物管理局審查的「美國製造醫療器材及藥品」,有美國FDA核發的上市許可,就可作為申請我國藥品藥證或醫材許可證的充分證據。
王德原解釋,目前藥品申請查驗登記要檢附研發、產品規格、製造、管制GMP等資料,還有臨床醫學、藥廠等相關資料並送到我國食藥署審查。而這樣的審查過程可能會超過一年,因此在台美關稅協定簽訂後,未來美國FDA美國核發的美國製造藥品,台灣這端是針對人種差異、適應症、臨床如何使用等,都還是會透過食藥署專業審查。
王德原說,但各自醫療體系、醫師診斷開藥的方式還是有不同。
不過,縮短時間多久,王德原則說,較難說明精準時間,但整個程序都會加快,只是每個產品所提供的資料完整度仍有差異;但整體會加速民眾使用安全有保障的優質藥品與高階醫材。此外,建置自費醫材核價單一平台,無須22縣市逐一審,簡化程序,加速臨床應用。
更多「台美關稅拍板」相關新聞。